制药行业的系统验证是确保计算机化系统适合其预期用途并满足当前监管要求的关键过程。这是 cGMP(现行药品生产质量管理规范)的强制性要求,对于管理制成品的质量至关重要。任何可能影响患者安全、产品质量和数据完整性的计算机系统都必须经过适当的验证。
进一步阅读或收听我们的人工智能播客:
验证的目的是以高效和有效的方式在现有行业良好实践的基础上更进一步。它包括通过以下方式证明 证据 确保每个计算机化系统都能始终如一地产生预期结果。为该行业验证工作提供参考的主要法规要求和指南包括 GxP(良好操作规范)法规、EudraLex 第 4 卷关于计算机化系统的附件 11、美国 FDA 关于电子记录和电子签名的 21 CFR 第 11 部分以及 ISPE GAMP 指南:基于风险的投诉 GxP 计算机化系统方法》(GAMP 5)。例如,GAMP 5 提供了实用指南,建立了通用语言,并推广了基于良好实践的系统生命周期方法。

在这种情况下,计算机化系统(如 Accevo 的 MES 或 EBR 系统)是一套软件和硬件组件,共同实现某些功能。应用软件应经过验证,而底层 IT 基础设施则应合格。如果计算机化系统取代了人工操作,则不应降低产品质量、流程控制或质量保证,也不应增加流程的整体风险。
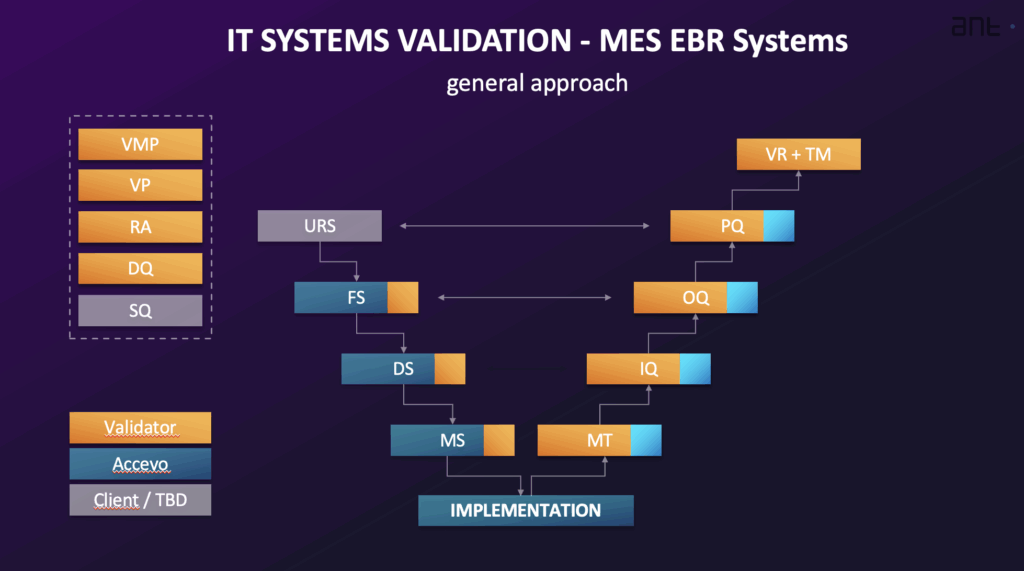
系统验证中的 V 模型
验证 MES 或 EBR 等计算机化系统的一般方法是将验证活动与系统的实施结合起来,通常遵循 系统生命周期.这一生命周期通常包括规划与规范、设计与开发、验证、运行和报废等阶段。验证工作的级别与系统的复杂程度(分类)和与指定用途相关的风险(cGxP 临界度)相称。验证过程通常用以下表格来描述 V 型.
典型的验证活动和相关文件包括
- 验证总计划 (VMP): 一份基础性文件,概述计划中的验证和鉴定活动,定义验证的范围、框架、质量体系标准、角色和职责、方法和交付成果。
- 验证计划 (VP): 描述实施和运行系统所需的具体活动和可交付成果,提供详细规划,界定责任,并列出必要文件。它为验证活动的系统性和可控性提供了证据。
- 用户需求规格(URS): 记录系统控制流程的业务需求和要求。它规定了系统必须执行的功能。URS 包括一般要求、监管要求(如数据完整性、审计跟踪和安全性要求)以及功能/流程要求。它应包括使用电子记录和签名并对监管有影响的地点清单。要求是唯一可识别的。
- 风险分析 (RA): 系统化流程,通常使用基于 GAMP 5 建议的简化 FMEA(失效模式与影响分析)等方法,用于评估、控制、沟通和审查整个系统生命周期内的风险。它评估系统的 GxP 相关性、数据完整性以及对质量流程的影响,包括确定纠正措施。验证活动通常基于风险分析的结论。
- 功能规范 (FS) 和软件/硬件设计规范 (DS): FS 描述用于满足 URS 中定义的要求的系统功能和模块。DS 记录如何构建系统,包括结构、算法、逻辑、数据格式和接口说明。DS 还包括配置和硬件/软件设计规范。FS 根据 URS 和任何建议文件创建,是功能测试的基础。设计鉴定 (DQ) 包括对项目文档进行评估,以确定系统的设计是否符合 GMP/GAMP 规则。
- 供应商资格 (SQ): 评估供应商是否能提供高质量的产品或服务,是否能满足监管要求,是否有适当的质量程序,以及是否能管理实施、支持和更新。
- 安装资格 (IQ): 根据规范验证所有系统组件(包括硬件和软件)的文件安装和配置。其中包括验证安装和配置的正确性。
- 操作资格 (OQ): 确认系统功能与功能规范中描述的一致。OQ 测试最关键的系统功能,特别是那些管理关键数据的功能,并包括正面和负面的测试结果。它应包括测试电子记录和签名的监管要求。OQ 通常在验证环境中进行。
- 性能鉴定 (PQ): 验证并记录用户需求是否得到满足。PQ 对 URS 中定义的系统管理的整个流程进行测试。PQ 测试通常在生产环境中使用真实数据进行。
- 可追溯性矩阵 (TM): 将 URS 中的所有技术要求映射到设计文件和测试程序(IQ/OQ/PQ)的相应部分。其目的是验证系统是否满足 URS 中定义的所有要求。它展示了用户需求与成功执行测试之间的关系。
- 验证摘要报告 (VSR): 验证流程结束时发布的文件,总结所有计划活动和交付成果。它分析收集的数据,报告测试结果(包括不符合项),确认活动按计划进行,根据验收标准评估测试结果,并明确说明系统已通过验证并可投入使用。可追溯性矩阵通常作为附件提供。
谁来验证?
验证由不同的角色进行,包括 流程负责人 (负责公司流程、审核验证文件、变更管理)、 系统所有者 (负责技术问题、基础设施、审批阶段)、 质量单位 (负责质量问题、审查/批准具体交付成果、确保合规)、 项目经理 (的责任(全面负责交付解决方案、审查交付成果),以及 供应商 (提供系统实施、咨询服务和测试)。
在整个系统生命周期中保持验证
验证不仅仅是实施时的一次性活动。维护 有效状态 在系统的运行寿命和退役阶段,对系统的支持也至关重要。这些阶段的活动包括移交、支持管理、性能监控、事故管理、CAPA、变更管理、维修、定期审查、备份和恢复、业务连续性、安全管理、系统管理、数据迁移和系统退役/处置。
这里所说的计算机化系统是一套软件和硬件组件,共同实现某些功能。应用软件应经过验证,而底层 IT 基础设施则应合格。如果计算机化系统取代了人工操作,则不应降低产品质量、流程控制或质量保证,也不应增加流程的整体风险。
验证计算机化系统的一般方法是将验证活动与系统的实施结合起来,通常遵循系统生命周期。这一生命周期通常包括规划和规范、设计和开发、验证、运行和报废等阶段。验证工作的级别与系统的复杂程度(分类)和与指定用途相关的风险(cGxP 临界度)相称。验证过程通常使用 V 模型来描述。
典型的验证活动和相关文件包括
- 验证总计划 (VMP): 一份基础性文件,概述计划中的验证和鉴定活动,定义验证的范围、框架、质量体系标准、角色和职责、方法和交付成果。
- 验证计划 (VP): 描述实施和运行系统所需的具体活动和可交付成果,提供详细规划,界定责任,并列出必要文件。它为验证活动的系统性和可控性提供了证据。
- 用户需求规格(URS): 记录系统控制流程的业务需求和要求。它规定了系统必须执行的功能。URS 包括一般要求、监管要求(如数据完整性、审计跟踪和安全性要求)以及功能/流程要求。它应包括使用电子记录和签名并对监管有影响的地点清单。要求是唯一可识别的。
- 风险分析 (RA): 系统化流程,通常使用基于 GAMP 5 建议的简化 FMEA(失效模式与影响分析)等方法,用于评估、控制、沟通和审查整个系统生命周期内的风险。它评估系统的 GxP 相关性、数据完整性以及对质量流程的影响,包括确定纠正措施。验证活动通常基于风险分析的结论。
- 功能规范 (FS) 和软件/硬件设计规范 (DS): FS 描述用于满足 URS 中定义的要求的系统功能和模块。DS 记录如何构建系统,包括结构、算法、逻辑、数据格式和接口说明。DS 还包括配置和硬件/软件设计规范。FS 根据 URS 和任何建议文件创建,是功能测试的基础。设计鉴定 (DQ) 包括对项目文档进行评估,以确定系统的设计是否符合 GMP/GAMP 规则。
- 供应商资格 (SQ): 评估供应商是否能提供高质量的产品或服务,是否能满足监管要求,是否有适当的质量程序,以及是否能管理实施、支持和更新。
- 安装资格 (IQ): 根据规范验证所有系统组件(包括硬件和软件)的文件安装和配置。其中包括验证安装和配置的正确性。
- 操作资格 (OQ): 确认系统功能与功能规范中描述的一致。OQ 测试最关键的系统功能,特别是那些管理关键数据的功能,并包括正面和负面的测试结果。它应包括测试电子记录和签名的监管要求。OQ 通常在验证环境中进行。
- 性能鉴定 (PQ): 验证并记录用户需求是否得到满足。PQ 对 URS 中定义的系统管理的整个流程进行测试。PQ 测试通常在生产环境中使用真实数据进行。
- 可追溯性矩阵 (TM): 将 URS 中的所有技术要求映射到设计文件和测试程序(IQ/OQ/PQ)的相应部分。其目的是验证系统是否满足 URS 中定义的所有要求。它展示了用户需求与成功执行测试之间的关系。
- 验证摘要报告 (VSR): 验证流程结束时发布的文件,总结所有计划活动和交付成果。它分析收集的数据,报告测试结果(包括不符合项),确认活动按计划进行,根据验收标准评估测试结果,并明确说明系统已通过验证并可投入使用。可追溯性矩阵通常作为附件提供。
底线
验证工作由不同角色执行,包括流程所有人(负责公司流程、审核验证文件、变更管理)、系统所有人(负责技术问题、基础设施、批准阶段)、质量单位(负责质量问题、审核/批准具体交付成果、确保合规)、项目经理(全面负责交付解决方案、审核交付成果)和供应商(提供系统实施、顾问服务和测试)。
验证不仅仅是实施时的一次性活动。在系统运行期间和退役阶段保持验证状态也至关重要。这些阶段的活动包括移交、支持管理、性能监控、事故管理、CAPA、变更管理、修复、定期审查、备份和恢复、业务连续性、安全管理、系统管理、数据迁移和系统报废/处置。
值得了解!在制药行业实施计算机化系统(如 OEE),无需验证即可支持本地非关键系统,请点击此处了解更多信息: 如何在 3 个月内实施无需验证的 OEE 监测系统?- 案例研究。
另请查看

